印塔健康|国产之光:泽布替尼!治疗华氏巨球蛋白血症临床数据优异!

文章图片
文章图片
此前 , 2019年11月14日 , 美FDA已批准泽布替尼上市 , 用于治疗之前接受过至少一种治疗的套细胞淋巴瘤(MCL)患者 。
华氏巨球蛋白血症作为一种易被忽视的B淋巴细胞恶性病变 , 在男性中更为常见 , 中位年龄为60-70岁 , 被归类于惰性疾病 , 中位生存期为5年 , 目前认为仍不可治愈 。 MYD88和CXCR4特征性分子遗传学异常在WM患者中常见 。 华氏巨球蛋白血症的表观基因组学 , 对BTK抑制剂的反应较好 。 基于基因突变的治疗路径:初治或难治性华氏巨球蛋白血症患者 , 应根据基因突变表型及复发次数选择不同方案治疗 。
泽布替尼是BTK的小分子抑制剂 。 泽布替尼在BTK活性位点与半胱氨酸残基形成共价键 , 导致BTK活性被抑制 , 从而减少恶性B细胞增殖 , 抑制肿瘤生长 。
BTK是B细胞抗原受体(BCR)和细胞因子受体通路的信号分子 。 在B细胞中 , BTK信号可激活B细胞增殖、转运、趋化和粘附所必需的通路 。
商品名:Brukinsa(百悦泽)
通用名:zanubrutinib(泽布替尼)
靶点:BTK
美国首次获批:2019年11月
中国首次获批:2020年6月
适应症:套细胞淋巴瘤、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(中国)、华氏巨球蛋白血症(中国)
推荐剂量:每次160mg , 每日2次或每次320mg , 每日1次 , 随餐或不随餐服用
临床数据此次批准是基于一项多中心、开放标签的III期临床试验ASPEN的结果 , 比较了泽布替尼和伊布替尼在MYD88 L265P突变的华氏巨球蛋白血症患者中的作用 。
该研究的队列1随机入组了201例携带MYD88突变的患者 。 研究的主要终点是独立审查委员会(IRC)在总体意向治疗(ITT)人群中评估的最佳的部分缓解率(VGPR) 。 另一项疗效观察指标是反应持续时间(DOR) 。
入组的患者人群特征包括:中位年龄为70岁 , 68%的患者为男性;2%的患者是亚裔 , 91%的患者是白人 , 7%的患者未知种族;93%的患者ECOG评分为0或1 , 1.7%的患者ECOG评分为2;共有82%的患者为复发/难治性疾病 , 其中85%既往接受过烷基化药物治疗 , 91%既往接受过抗CD20治疗;复发/难治性疾病患者既往治疗的中位数为1(范围:1-8);共有91例(45%)患者具有国际预后评分系统(IPSS)高华氏巨球蛋白血症 。
试验结果显示 , 根据标准版的第六届华氏巨球蛋白血症国际工作组(IWWM-6)缓解标准(Owen et al 2013) , 泽布替尼治疗组(n=102) VS 伊布替尼治疗组(n=99)的最佳的部分缓解率(VGPR)为15.7% VS 7.1%;部分缓解(PR)为61.8% VS 70.7% , 反应率(RR=CR+VGPR+PR)为77.5% VS 77.8%;在12个月时 , 94.4% VS 87.9%的患者反应仍在持续缓解中 。
根据修订版的IWWM-6缓解标准(Treon 2015) , 泽布替尼治疗组 VS 伊布替尼治疗组的VGPR为28.4% VS 19.2%;部分缓解(PR)为49% VS 58.6% , 反应率(RR=CR+VGPR+PR)为77.5% VS 77.8%;在12个月时 , 94.4% VS 87.9%的患者反应仍在持续缓解中 。
图注:泽布替尼治疗华氏巨球蛋白血症(WM)患者的临床数据
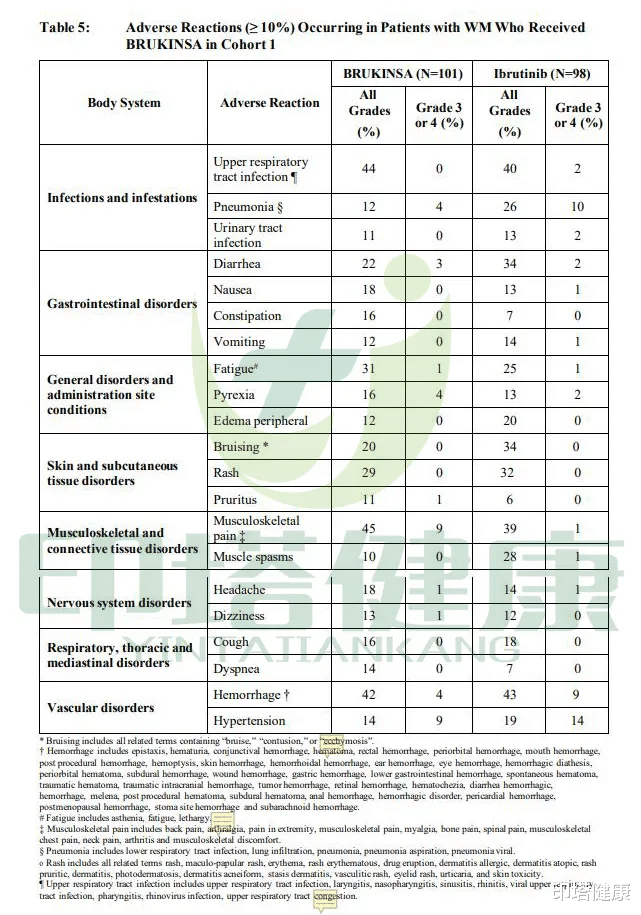
不良反应【印塔健康|国产之光:泽布替尼!治疗华氏巨球蛋白血症临床数据优异!】
经验总结扩展阅读
- 什么家有柯基:柯基幼犬可以吃什么 小柯基吃什么又营养又健康?
- 护肤品 国产化妆品哪个牌子好 十款最好用的国产护肤品排行榜
- 温漾 国产化妆品哪个牌子好 十款最好用的国产护肤品排行榜
- 东西方健康艳丽才是最好的,东西方的审美,是有很大差别的
- 洗发水 蓄力追赶海飞丝,国产洗发水迎来新曙光,网友:好用自然是王道
- 运动 咖啡真的不健康吗?到底能不能减肥?
- 人参“减法”更健康,参谷无硅油健康洗护挑战三大极致体验
- 国产 盘点国产十大护肤品牌及热门产品,看看你用过哪些!
- 血糖 糖尿病人建议要减肥,那如何才能健康安全的减肥呢?不妨看看!
- 进行肌肤更新的两大关键词