领蔚生物 Mol Psychiatry︱抑郁症生物标记物新的发现——外泌体中的线粒体蛋白

文章图片
文章图片
重度抑郁症(major depressive disorde , MDD)是由于患者个体内遗传系统(基因)存在异常 , 或后天环境的巨变所引起的一种情绪性功能障碍 , 以持久自发性的情绪低落为主的一系列抑郁症状 , 世界卫生组织将其列为全球导致残疾的最大因素[12
。 尽管MDD的患病率和发病率很高 , 但是目前MDD的诊断手段并不可靠 。 一线药物治疗也并不完全有效 , 只有27%的患者在首次治疗后缓解 , 67%在四次完整治疗后才缓解 。
为了很好地评估和发展新的治疗方法 , 需要鉴定参与MDD致病机制的特定的生物标志物 , 从而揭示与其相关的治疗靶标[3 4
。 既往研究表明 , 抑郁症患者血液中某些神经递质、色氨酸代谢物、内分泌激素、免疫细胞因子、生长和神经营养因子的浓度与对照组有显著差异[5-9
, 其中 , 生长和神经营养因子的下降 , 免疫细胞因子和皮质醇的上升 , 与对治疗反应呈正相关[57
。 但这些生物标志物的变化缺乏疾病特异性 , 也无法用于预测评估疾病的严重程度和对治疗的反应 。 新的研究表明 , 精神疾病中神经元线粒体数量、形态和电子传递活性显著改变 , 而线粒体DNA多态性增加、缺失和突变也提示线粒体异常可能是MDD的基本致病机制[10
。 在应激性情绪障碍中 , 也可以观察到线粒体DNA拷贝数的变化和线粒体呼吸链酶活性的改变[11
。 最近对首发精神病患者神经元源性细胞外囊泡的分析显示 , 相对于对照组 , 线粒体电子传递复合物、结构成分和神经保护因子水平异常[14 15
。
2021年9月份 , 美国加州大学医学院的Edward J. Goetzl(第一作者 , 通讯作者)与合作者在Molecular Psychiatry上发表了题为“Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder”的文章 , 对比MDD患者在接受特异性5 -羟色胺再摄取抑制剂(SSRI)治疗前后 , 与相应年龄性别的健康对照组中神经元源性细胞外囊泡的功能性线粒体蛋白的差异 , 这有可能成为有用的抑郁症生物标志物 , 并且成为药物靶标 。
细胞外囊泡是由细胞主动释放的多样的纳米级膜囊泡 , 类似大小的囊泡可根据其生物发生、大小和生物物理性质进一步分类(如外泌体、微囊泡) 。 作者团队由此开发了一个平台 , 用于研究在血浆神经元源性细胞外囊泡(neuron-derived extracellular vesicles , NDEVs)中的神经元线粒体蛋白(MPs) , 这些蛋白富集于外泌体亚群 , 因此检测其外泌体水平也可反映大脑神经元中的MPs含量[1213
。
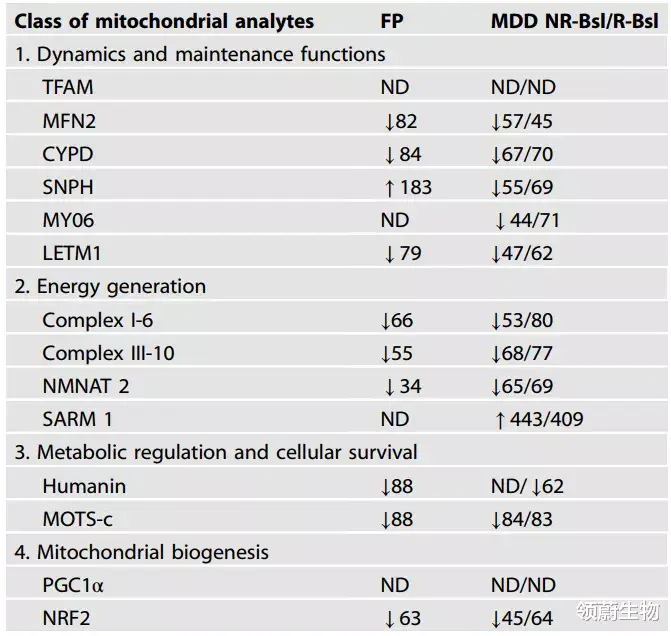
在20名前后接受SSRI治疗的MDD患者的血浆NDEVs(包括外泌体)和10名对照组的NDEVs中 , 作者对14种哺乳动物神经元线粒体蛋白进行了量化 。 首发精神病患者的血浆NDEV水平与健康对照组相比有显著差异[1415
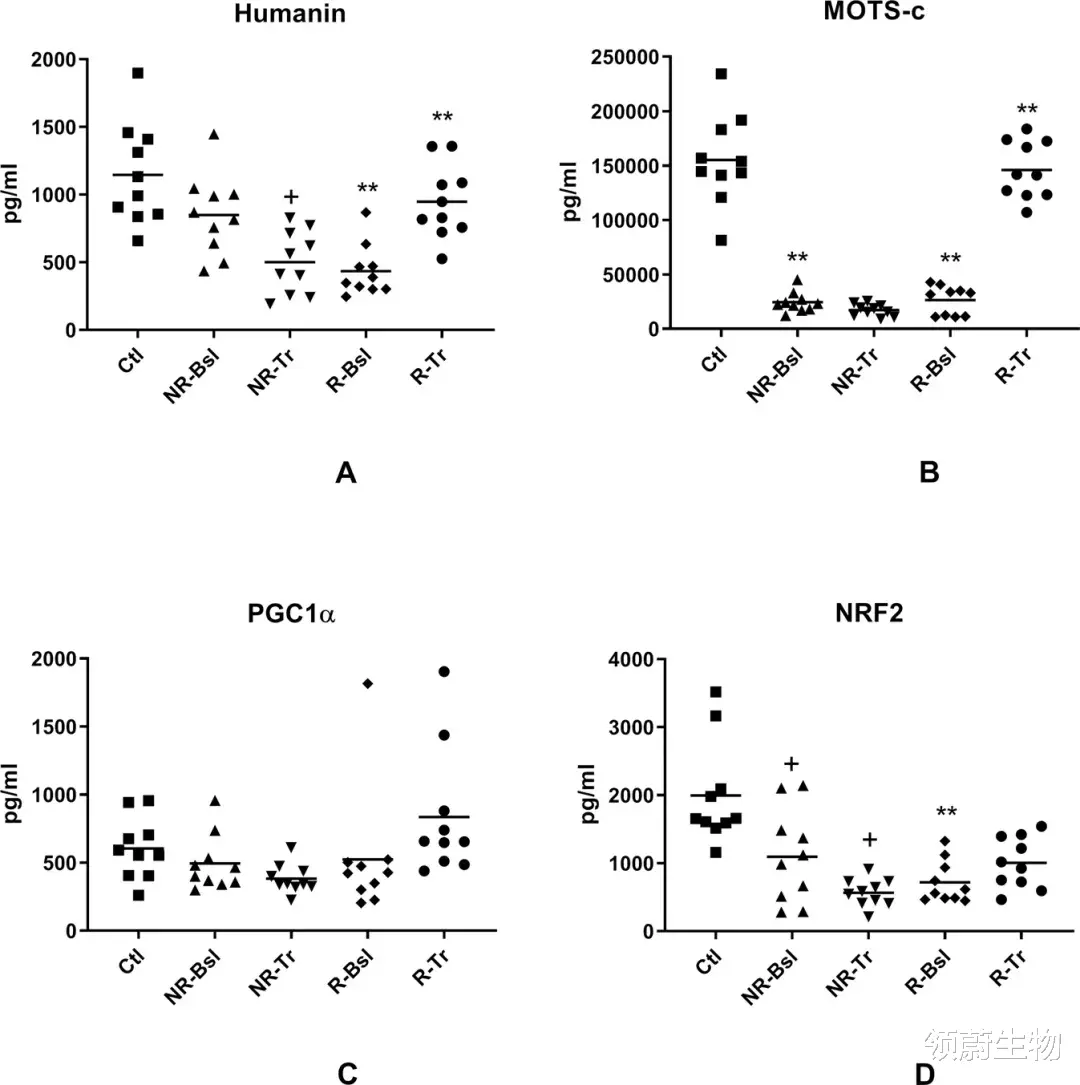
。 图1展示各神经元蛋白的NDEV水平(包括外泌体标记物CD81) 。 对SSRI有反应的群体治疗前(R-Bsl)的CD81(图1A)水平比正常对照(Ctl)稍微增加 , 在治疗后恢复到正常水平(R-Tr) 。
图1 参与线粒体动力学和其他维护功能的NDEV蛋白水平
(图源:Goetzl E. Jet al. Mol Psychiatry.2021)
本研究中观察的第一类蛋白为涉及线粒体动力学和功能维护的NDEV线粒体蛋白 , 包括转录因子TFAM , 膜电位、代谢和孔通透性的CYPD调节因子 , 线粒体融合和分布所需的MFN2 , 以及将线粒体锚定在轴突微管和突触前区域微丝上的栓系蛋白SNPH和MY06(表1)[16-20
经验总结扩展阅读
- 原料发挥第四代生物活性化妆品优势,拾妆护肤品沉下心做产品
- @qq深圳钰美生物28天祛斑宣传是否存在夸大宣传
- 成功10年老斑有救啦!伯朗基美肤水,开启生物焕颜之旅!
- 玻尿酸 诞生了润百颜、故宫口红这些爆款的华熙生物,这次把玻尿酸加入了水中
- 总决赛逐美巅峰,决战羊城 | 远想生物问题肌案例新星赛总决赛圆满收官!
- 能力伊康生物制药科普:敏感肌面部护理小知识
- molly 秋冬护肤最佳拍档,“精华,面霜”最佳CP大合集来啦,你用过几种
- 企业化妆品原料企业稳健增长,华熙生物做对了什么?
- 独角兽公司 全球独角兽公司丨中国301家世界第二 菲鹏生物等松山湖企业上榜
- ipo 创尔生物上市“闯关”失败,“医美面膜”的财富密码也失效了?












