1、酸碱指示剂的变色范围是什么?酸碱指示剂的变色范围是pH值为3.1-4.4 。酸碱指示剂既然都是一些有机弱酸或有机弱碱,那么在不同的酸碱性溶液中 , 它们的电离程度就不同,于是会显示不同的颜色 。pH试纸则是由多种指示剂混合液制成的,通常情况下pH试纸就显金黄色,pH≈5 。
可见在制作时,已将指示剂混合液调至弱酸性 , 并不是中性,这是为了减弱空气中CO2对测定的影响 。此外,中和反应时,使用酸碱指示剂只能用2~3滴,也是因为酸碱指示剂都是有机酸或有机碱,用多了会增大误差的 。
影响因素
在实际中,影响酸碱指示剂变色范围的因素主要有两方面:一种是影响指示剂常数KHln的因素,包括温度、溶剂、溶液的离子强度等,其中温度的影响较大 。另一种是影响变色范围宽度的因素 , 如指示剂用量、滴定程序等,现具体讨论如下 。
1、温度温度改变时,指示剂常数KHln及水的离子积KW均有改变,因此指示剂的变色范围也随之发生改变 。例如,18℃时,甲基橙的变色范围为3.1~4.4,而100℃时,变为2.5~3.7 。因此,滴定宜在室温下进行 。如必须加热,应该将溶液冷却后再进行滴定 。
2、溶剂指示剂在不同溶剂中其pKHln值是不同的,因此在不同溶剂中的变色范围不同 。例如,甲基橙在水溶液中pKHln=3.4,在甲醇中pKHln=3.8 。
3、中性电解质溶液中性电解质的存在增加了溶液的离子强度,使指示剂常数改变 , 影响到指示剂的变色范围 。此外 , 某些电解质还具有吸收不同波长光波的性质 , 会引起指示剂颜色深度、色调及变色灵敏度的改变 。所以在滴定溶液中不宜有大量盐类存在 。
文章插图
文章插图
2、化学中酸碱指示剂变色范围,和什么会变色一、指示剂的作用原理
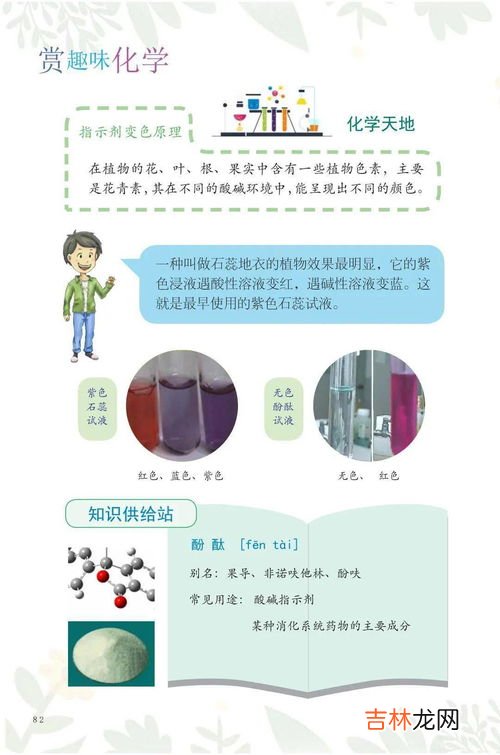
1、酸碱指示剂:一般是某些有机弱酸或弱碱 , 或是有机酸碱两性物质,它们在酸碱滴定过程中也能参与质子转移反应,因分子结构的改变而引起自身颜色的变化,并且这种颜色伴随结构的转变是可逆的 。例如酚酞,甲基橙 。
2、分类:
单色指示剂:在酸式或碱式型体中仅有一种型体具有颜色的指示剂 。如酚酞
双色指示剂:酸式或碱式型体均有颜色的指示剂 。如甲基橙 。
二、指示剂变色的ph范围:
1、变色原理:以hin表示指示剂
hin
=
h+
+
in-
酸式型体
碱式型体
ka为指示剂的解离常数
⑴、溶液的颜色是由[in-]/[hin]的比值来决定的,随溶液的[h]的变化而变化 。
⑵、当[in-]/[hin]≤1/10
ph≤pka-1
酸式色
当10>[in-]/[hin]>1/10
ph在pka±1之间
颜色逐渐变化的混合色
当[in-]/[hin]≥10
ph≥pka+1
碱式色
2、变色范围:当溶液的ph由pka-1变化到pka+1(或相反)时,才可以观察到指示剂由酸式色经混合色变化到碱性色,这一颜色变化的ph范围,即ph===pka±1称为指示剂的变色范围 。
3、理论变色点:当指示剂的酸式型体与碱式型体的浓度相等,即[in-]/[hin]==1时,溶液的ph
=
pka
,称为指示剂的理论变色点 。
三、影响指示剂变色范围的因素:
1、指示剂的用量:
双色指示剂:指示剂的变色范围不受其用量的影响 。但指示剂的变色也要消耗一定的滴定剂,从而引入误差 。
单色指示剂:单色指示剂的用量增加 , 其变色范围向ph减小的方向发生移动 。
使用时其用量要合适 。
2、温度:温度的变化会引起指示剂解离常数和水的质子自递常数发生变化,因而指示剂的变色范围亦随之改变,对碱性指示剂的影响较酸性指示剂更为明显 。
经验总结扩展阅读
- 花生四烯酸是必需脂肪酸吗,对幼畜很重要的三种必需脂肪酸
- 谷雨节气温特点 这三种天气要明白
- 经常吃花生,对血管是保护还是伤害?三种错误吃法对身体没好处
- 哪三种呼噜声需要去看医生样,有些人睡觉呼噜声很重,这到底是什么原因引起的?
- 表格文字怎么换行
- 魅蓝怎么买?三种魅蓝预约途径
- 心智透明原则,想要成为一个心智成熟的人,你需要具备这三种能力,缺一不可
- 山药禁忌人群,山药三种人不能吃
- 表格里数字不全部显示出来怎么办,Excel表格内容显示不全的三种处理方法
- 歪歪有几种房间模式