1、电子的排布规律1、电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布 。
2、每层最多容纳的电子数为2n²个(n代表电子层数) 。
3、最外层电子数不超过8个(第一层不超过2个),次外层不超过18个,倒数第三层不超过32个 。
4、电子一般总是尽先排在能量最低的电子层里,即先排第一层 , 当第一层排满后,再排第二层,第二层排满后,再排第三层 。
电子云是电子在原子核外空间概率密度分布的形象描述 , 电子在原子核外空间的某区域内出现,好像带负电荷的云笼罩在原子核的周围,人们形象地称它为“电子云” 。它是1926年奥地利学者薛定谔在德布罗伊关系式的基础上,对电子的运动做了适当的数学处理,提出了二阶偏微分的的著名的薛定谔方程式 。这个方程式的解,如果用三维坐标以图形表示的话,就是电子云 。电的速度虽然很快,仅次于光速,但是在没有形成电路之前,一个电子走完1米长的导线大约要1小时长,比蜗牛还慢!
因为电子绕核高速旋转,所以电子不可能决定分子的键长和键角 。“电子排布规律”是主观臆想,其逻辑性再严谨也是无稽之谈 。可以肯定,原子核决定原子的性能,根据晶体结构和分子结构来推测原子核结构才是正确的研究方向 。
文章插图
文章插图
2、原子核外电子排布规律原子核外电子排布规律如下:
1.电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布;
2.每层最多容纳的电子数为2n2(n代表电子层数);
3.电子一般总是尽先排在能量最低的电子层里 , 即最先排第一层,当第一层排满后,再排第二层,等等 。
4.最外层电子数则不超过8个(第一层为最外层时,电子数不超过2个) 。

文章插图
文章插图
3、元素周期表中元素的核外电子排布有哪些规律?核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;
③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个 , 倒数第三层电子数不超过32个 。
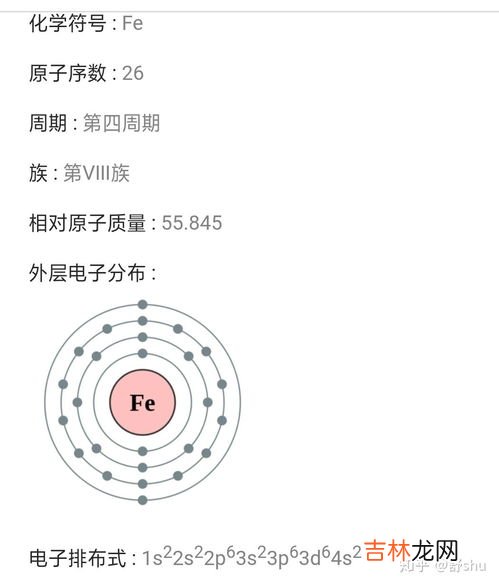
原子的核外电子排布与轨道表示式、原子结构示意图的关系:原子的核外电子排布式与轨道表示式描述的内容是完全相同的,相对而言,轨道表示式要更加详细一些,它既能明确表示出原子的核外电子排布在哪些电子层、电子亚层上 。
还能表示出这些电子是处于自旋相同还是自旋相反的状态,而核外电子排布式不具备后一项功能 。原子结构示意图中可以看出电子在原子核外分层排布的情况,但它并没有指明电子分布在哪些亚层上,也没有指明每个电子的自旋情况,其优点在于可以直接看出原子的核电荷数(或核外电子总数) 。
原子的核外电子排布与元素周期律的关系
如第一周期中含有的元素种类数为2 , 是由1s1~2决定的
第二周期中含有的元素种类数为8,是由2s1~2 2p0~6决定的
【电子层排布规律,电子的排布规律】第三周期中含有的元素种类数为8,是由3s1~2 3p0~6决定的
第四周期中元素的种类数为18,是由4s1~2 3d0~10 4p0~6决定的 。 [2]
由此可见 , 元素原子核外电子排布的规律是元素周期表划分的主要依据,是元素性质周期性变化的根本所在 。对于同族元素而言,从上至下 , 随着电子层数增加,原子半径越来越大,原子核对最外层电子的吸引力越来越小 。
最外层电子越来越容易失去,即金属性越来越强;对于同周期元素而言,随着核电荷数的增加,原子核对外层电子的吸引力越来越强,使原子半径逐渐减?。鹗粜栽嚼丛讲睿?非金属性越来越强 。
扩展资料
元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律 。元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果 。
电子的排布情况 , 即“电子构型”,是元素性质的决定性因素 。为了达到全充满、半充满、全空的稳定状态,不同的原子选择不同的方式 。具有同样价电子构型的原子 , 理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因;同一族元素中,由于周期越高,价电子的能量就越高 , 就越容易失去 。
元素周期表中的区块是根据价电子构型的显著区别划分的 。不同区的元素性质差别同样显著:如s区元素只能形成简单的离子,而d区的过渡金属可以形成配合物 。
编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同的各元素从左到右排成一横行 。(周期序数=原子的电子层数)
③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行 。
主族序数=原子最外层电子数
判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)——
①单质与水或酸反应生成氢气容易(难);
②氢氧化物碱性强(弱);
③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu 。
(2)非金属性强(弱)——
①单质与氢气易(难)反应;
②生成的氢化物稳定(不稳定);
③最高价氧化物的水化物(含氧酸)酸性强(弱);
④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2 。
参考资料:百度百科——核外电子排布
文章插图
文章插图
4、电子层排布规律是什么?电子层可用(n=1、 2、3… 表示,n=1表明第一-层电子层(K层) , n=2表明第二电子层(L层),依次n=3、4、5时表明第三(M层)、第四(N层)、第五(O层(念错成零层) ) 。
一般随着n值的增加 , 即按K、L、M、N、0.. 的顺序,电子的能量逐渐升高,电子离原子核的平均距离也越来越大 。电子层可容纳最多电子的数量为2n2 。
扩展资料:
注意事项:
根据原子轨道能级的相对高低,可划分为若干个电子层,同一电子层又可以划分为若干个电子亚层 。电子层排布公式为np>(n-1)d>(n-2)f>ns 。
各电子层最多容纳的电子数是2n²个(表示电子层) 。最外层电子数不超过8个(K层是最外层时 , 最多不超过2个),次外层电子数目不超过18个 , 倒数第三层不超过32个 。
参考资料来源:百度百科-电子层排布

文章插图
文章插图
5、电子层数排布规律是什么?电子层排布规律(n=1、2、3)表示,n=1表明第一层电子层(K层),n=2表明第二电子层(L层),依次n=3、4、5时表明第三(M层)、第四(N层)、第五(O层(念错成“零层”)) 。电子层可容纳最多电子的数量为2n² 。
电子在原子核外运动状态是相当复杂的 。一个电子的运动状态取决于它所处的电子层、电子亚层、轨道的空间伸展方向和自旋状况 。科学实验还告诉我们,在一个原子里不可能存在着电子层、电子亚层、轨道的空间伸展方向和自旋状况完全相同的两个电子 。
这个原理叫泡利不相容原理 。根据这个原理,可以知道每一个轨道中只能容纳两个自旋相反的电子 。根据这一点,可以推算出每个电子层中最多可容纳的电子数 。
电子层能量
如果没有外界能量输入的话,电子会尽可能降低自身能量 。能量低的电子在离核较近的区域运动,能量高的电子在离核较远的区域运动 。
而电子总是尽先排布在能量最低的电子层里 。也就是说,在通常情况下 , 低层有了空位,高层的电子会释放光子降低能量填补到低层去(在外面跑大圈是很累的) 。
经验总结扩展阅读
- 陈紫函在山河令中演的是什么,电视剧山河令薄情簿主谁演的
- 手表电池多少钱一个,阿玛尼手表没电了换电池多少钱?
- 任何电气设备在未验明无电之前不能怎么样,任何电气设备在未验明无电之前一律认为有电对吗
- 磁场表现为对什么的作用力,磁场对运动电荷的作用力是什么?
- 洛12钢是什么材料,洛12钼钒材料可以电镀吗
- 苹果为什么充不进电,iphone手机怎么充不进电去了,怎么回事?
- 京东怎么预定笔记本维修,京东上所购笔计本电脑未过保修期,怎样联系售后维修?
- 手表回收哪个平台价格高,回收电话手表哪个平台最好?
- 一般电子表用什么型号电子,单相电子式电能表的规格型号是多少?请专业人士指导一下。
- 潮州光伏发电品牌排行榜,中国十大光伏发电品牌