领蔚生物|新进展!清华大学报道:基因修饰联合3D微载体递送增强干细胞疗法改善糖尿病疗效
文章图片
文章图片
文章图片
\"
前言
全世界目前有超过四亿的二型糖尿病(T2DM)患者 , 仅在2019年因为糖尿病及其并发症而死亡的人数高达420万 。 T2DM已成为威胁人类生命健康最为严重的慢性病之一 。
其主要临床表现为胰岛素抵抗、胰岛功能耗竭 。
传统T2DM治疗药物依然难以使部分患者血糖恢复正常 , 并且有造成低血糖、腹泻、恶心、呕吐等多种不良反应的可能性 。
近年来 , 以间充质干细胞(MSCs)为代表的干细胞疗法为治疗糖尿病提供了新的手段和希望 。 然而 , 糖尿病患者体内高血糖所产生的微环境压力显著抑制了干细胞MSCs在体内的存活时间从而最终影响其治疗效果 。
【领蔚生物|新进展!清华大学报道:基因修饰联合3D微载体递送增强干细胞疗法改善糖尿病疗效】\"
为了增强MSCs针对T2DM的疗效 , 清华大学杜亚楠研究团队利用慢病毒感染体系对人脂肪来源的MSCs进行Exendin-4的基因修饰(MSC-Ex4) , Exendin-4是胰高血糖素样肽-1受体激动剂(GLP-1RAs)家族中的一员 , 已经在临床上批准用于治疗T2DM 。
然而Exendin-4作为只有39个氨基酸的多肽 , 极易被肾脏清除 , 在体内半衰期只有半天 。
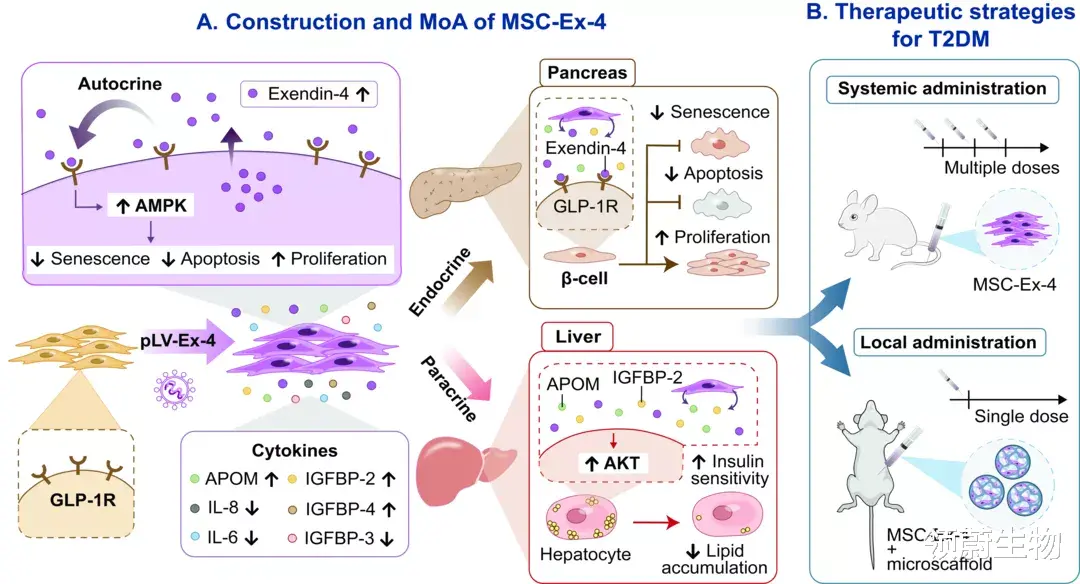
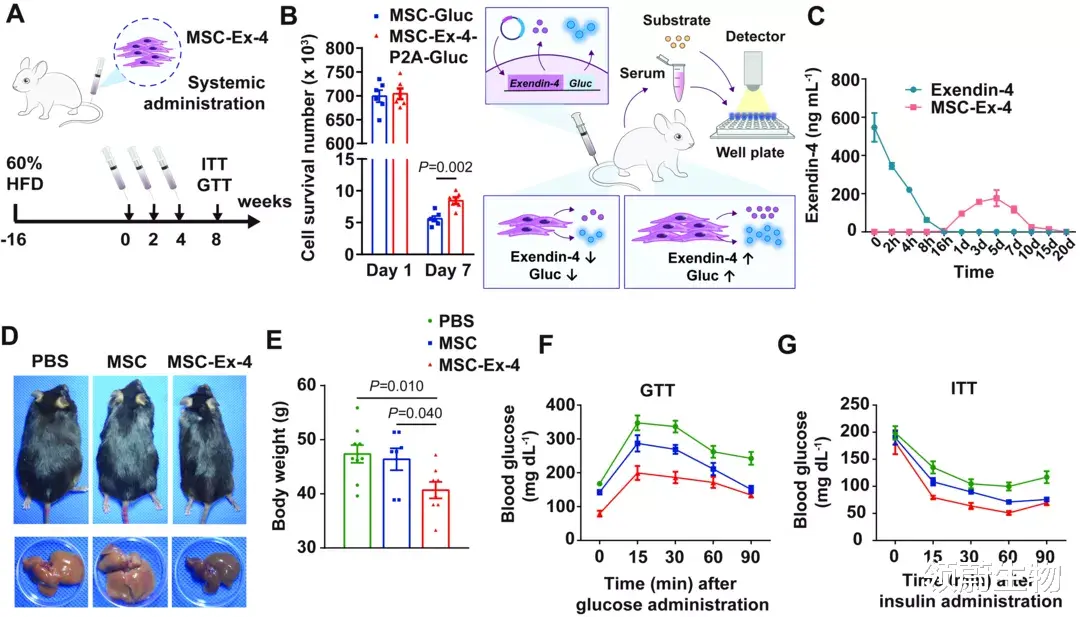
本研究中 , 研究人员发现注射MSC-Ex-4小鼠体内Exendin-4浓度达峰时间可显著延长 , 实现了Exendin-4的长效释放 。 并且由于MSC内源表达Extendin-4的受体GLP-1R , 因此MSC-Ex-4可通过自分泌效应增强自身在糖尿病高糖环境下的存活和疗效 , 同时其分泌的其他活性因子可通过内分泌作用保护胰腺β细胞 , 并通过旁分泌作用改善肝细胞胰岛素敏感性 , 减少肝细胞脂质积累(图1) 。
图1. MSC-Ex-4的构建示意图 , 对胰腺和肝脏细胞的潜在作用机制和对T2DM的治疗策略 。
(A)通过慢病毒转导系统构建Exendin-4基因工程MSCs (MSC-Ex-4) , 在不断释放Exendin-4的同时可对APOM、IGFBP2等蛋白因子分泌进行调节 。 其中 , MSC-Ex-4分泌的Exendin-4可通过自分泌与自身的GLP-1R相互作用延长其在高糖应激下的抗逆能力 。 同时MSC-Ex-4分泌的其他活性因子可通过内分泌作用保护胰腺β细胞 , 通过旁分泌作用改善肝细胞胰岛素敏感性 , 减少肝细胞脂质积累 。
(B)多次系统性注射可以显著改善二型糖尿病症状 。 通过注射3D明胶微支架辅助MSC-Ex-4作为细胞包封和给药载体 , 单次局部给药可实现长效治疗效果 。
MSC-Ex-4在模拟T2DM高糖环境的体外模型中表现出良好的抗逆能力 。
进一步研究证实 , 这种能力得益于MSC-Ex-4自分泌的Exenidn-4配体结合了自身表达的GLP-1R受体并激活下游的AMPK信号通路 , 从而促进了细胞增殖 , 并且显著增强了抗凋亡及抵抗衰老能力 。
与此同时 , MSC-Ex-4分泌的Exendin-4可促进胰岛β细胞增殖 , 抑制其衰老和凋亡 。 进一步 , 通过对MSC-Ex-4的转录组和分泌组学进行分析 , 发现其分泌的大量生物活性因子(如IGFBP2、APOM等)也可通过旁分泌作用激活肝脏细胞PI3K-AKT信号通路从而改善肝脏胰岛素敏感性并减少脂质积累(图2) 。
图2. MSC-Ex-4在高糖环境下抗凋亡和抗衰老能力增强 , 细胞内AMPK信号通路被激活(A-C) 。
同时MSC-Ex-4可促进胰岛细胞增殖和抑制凋亡(D-F) , 并通过分泌因子激活肝脏细胞PI3K-AKT信号通路(G-I) 。
经验总结扩展阅读
- 原料发挥第四代生物活性化妆品优势,拾妆护肤品沉下心做产品
- @qq深圳钰美生物28天祛斑宣传是否存在夸大宣传
- 成功10年老斑有救啦!伯朗基美肤水,开启生物焕颜之旅!
- 玻尿酸 诞生了润百颜、故宫口红这些爆款的华熙生物,这次把玻尿酸加入了水中
- 总决赛逐美巅峰,决战羊城 | 远想生物问题肌案例新星赛总决赛圆满收官!
- 能力伊康生物制药科普:敏感肌面部护理小知识
- 企业化妆品原料企业稳健增长,华熙生物做对了什么?
- “江歌案”新进展,把闺蜜锁在门外的刘鑫,比你想象得更残忍
- 刘鑫|“江歌案”新进展,把闺蜜锁在门外的刘鑫,比你想象得更残忍
- 独角兽公司 全球独角兽公司丨中国301家世界第二 菲鹏生物等松山湖企业上榜