印塔健康|肿瘤患者营养不良时,会影响生存预后?影响免疫治疗疗效?
2021年8月 , 《肺癌转化研究》杂志发表了一项前瞻性、观察性研究结果 , 旨在研究癌症恶病质综合征(CCS)对接受 PD-1/PD-L1 抑制剂治疗的非癌基因驱动的转移性非小细胞肺癌(NSCLC)患者治疗结果的影响 。
癌症恶病质综合征(CCS)是一种复杂的代谢综合征 , 其特征是体重减轻、身体成分改变和病理生理背景 , 定义为持续的炎症过程 。 在晚期肿瘤患者中 , 恶病质的发生率高达50%~80% , 约20%的肿瘤患者直接死于恶病质 。 而且 , 还与不良生存预后和降低治疗疗效有关 。
除了众所周知的对宿主代谢稳态失调的影响外 , CCS还与免疫系统功能障碍和感染易感性增加有关 。 CCS的特点是一种复合分子发病机制 , 涉及广泛的炎症过程 , 包括血清或肿瘤微环境(TME)中某些细胞因子的水平升高 , 例如如肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-8和生长分化因子(GDF)-15以增加骨髓源性抑制细胞(MDSCs)的血浆或TME浓度 。
绝大多数已在实验模型中被证实会影响癌症免疫周期 , 并对抗肿瘤免疫产生负面影响 。
临床研究如果患者在免疫治疗开始前的最后6个月内体重减轻>5%或任何程度的体重减轻>2%且体重指数(BMI)<20 kg/m^2 , 则患者被归类为患有癌症恶病质 , 或者第三腰椎骨骼肌指数(LSMI):男性<55 cm^2/m^2 , 女性<39^2 cm/m^2 。 在免疫治疗开始时使用腹部CT扫描计算LSMI , 此后每3个月计算一次 。
在该研究中 , 共有83例患者被纳入分析 。 中位随访时间为9.53个月 。 患者的特征包括:中位年龄为66岁 , 84.3%的患者为男性 , 92.8%的患者为正在或曾经吸烟 。 平均基线BMI为26.69 kg/m^2 , 38.6%的患者基线BMI 值<25 kg/m^2 。
79.5%的患者接受了免疫治疗作为二线治疗 , 其余患者作为一线治疗 。 所有接受免疫治疗作为二线治疗的患者之前都曾接受过铂双药治疗 。 只有2例患者(2.4%)接受了免疫治疗联合化疗 , 其余患者作为单药治疗 。
43例患者(51.8%)在免疫治疗开始时被归类为基线癌症恶病质综合征;28例患者在免疫治疗开始时的第一次评估中具有可评估的 LSMI 值 。
分析结果表明 , 基线BMI <25 kg/m^2和癌症恶病质的存在与较差的客观缓解率(ORR)显著相关 。
癌症恶病质与较差的疾病控制率(DCR)、基线 LSMI <正常下限、BMI <25 kg/m^2和>2个器官的转移扩散显著相关(P=0.034) 。
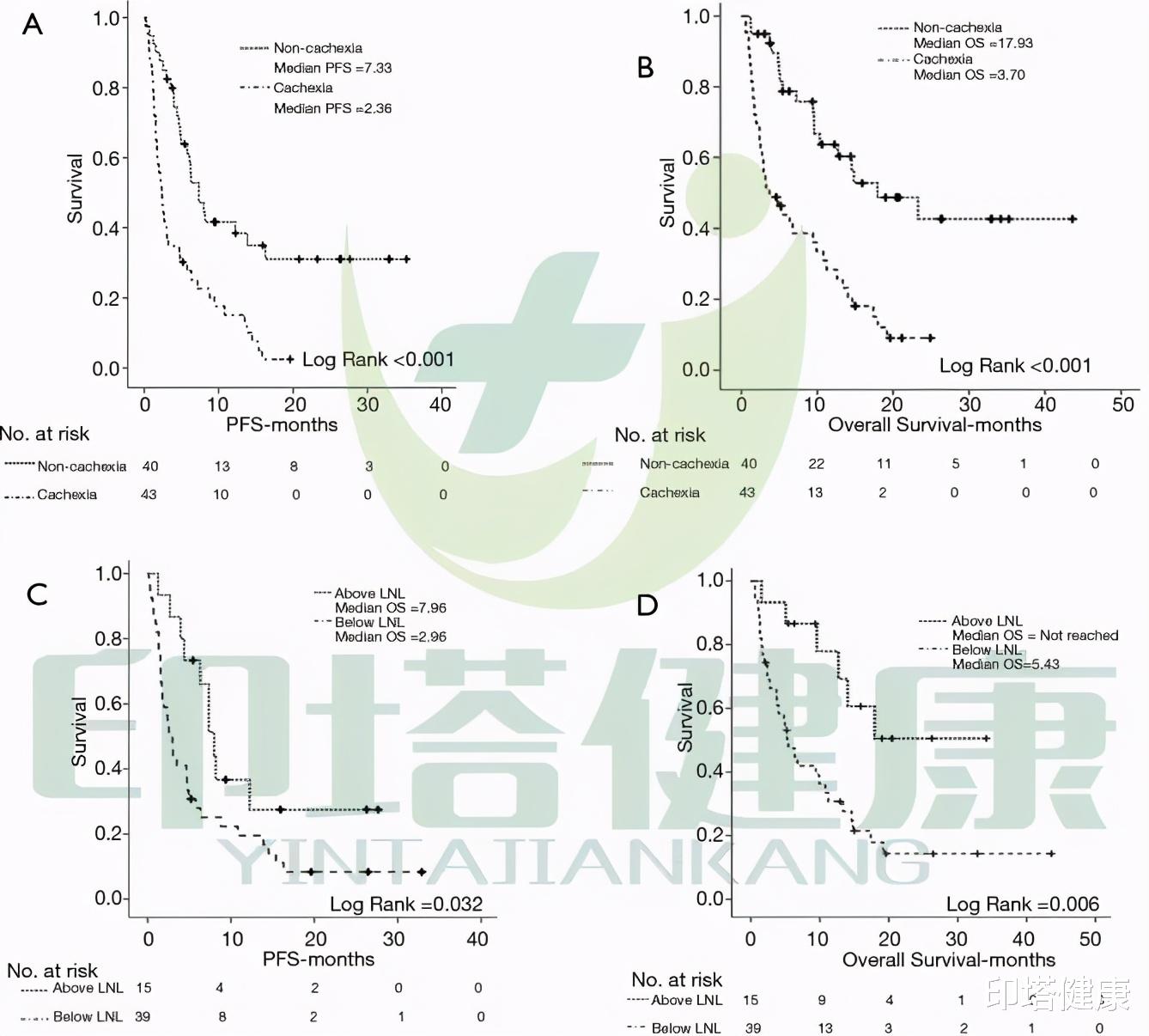
与非癌症恶病质患者相比 , 基线癌症恶病质患者与较差的无进展生存期(PFS)(2.36个月 VS 7.33个月)和较差的生存期(OS)(3.7个月 VS 17.93个月)显著相关 。
与LSMI基线值和骨骼肌减少不一致的患者相比 , 和骨骼肌减少相一致的基线LSMI患者的PFS(2.96 VS 7.96个月)和OS(5.43个月 VS 未达到)显著降低 。
图注:Kaplan-Meier曲线描述了基线CCS对PFS (A)、OS (B)的影响 , 以及基线LSMI值对PFS (C)和OS (D)的影响 。
基线癌症恶病质的存在显著降低了接受免疫治疗作为一线治疗的患者亚组(未达到 VS 13.37 个月)和接受免疫治疗作为二线治疗的患者亚组的生存期(12.7个月 VS 3.23个月) 。 最后 , 基线癌症恶病质的存在与自免疫治疗开始后较差的6个月生存率显著相关 。
在多变量分析中 , 基线癌症恶病质的存在是低生存期的独立预测因素 , HR =2.52 。 治疗期间LSMI >5%的降低并不影响OS 。
结论据了解 , 这是全球首个研究癌症恶病质对免疫治疗结果影响的前瞻性研究 。
基线癌症恶病质与PD-1/PD-L1抑制剂在非小细胞肺癌患者中的疗效降低相关 , 并且它是较差 PFS 和 OS 的独立预测因子 。 低于肌肉减少症阈值的LSMI值也与较差的生存结果相关 。
经验总结扩展阅读
- 什么家有柯基:柯基幼犬可以吃什么 小柯基吃什么又营养又健康?
- 东西方健康艳丽才是最好的,东西方的审美,是有很大差别的
- 运动 咖啡真的不健康吗?到底能不能减肥?
- 人参“减法”更健康,参谷无硅油健康洗护挑战三大极致体验
- 血糖 糖尿病人建议要减肥,那如何才能健康安全的减肥呢?不妨看看!
- 进行肌肤更新的两大关键词
- 急救这些品牌面霜具有超强的修复能力,帮助缔造健康、富有弹性的肌肤
- 加州新年如虎添“E” 与加州巴旦木开启健康光彩新一年
- 果酸真香警告,不看后悔!祛痘经验大分享,记录我从烂脸变健康皮的小妙招!
- 69岁洪金宝暴瘦到脱相,儿媳解释因“断食法”瘦身,身体很健康