传统的新生隐球菌的分型主要采用依据荚膜抗原决定簇的血清分型方法 。但仅能分成数种血清型 , 用于菌株间的变异分析显得无能为力 。有资料表明相同血清 型的新生隐球菌菌株可呈现明显不同的病理、生理反应[1 , 2]。我们采用pcr指纹技术对新生隐球菌不同分离株进行了dna多态性分析 , 现将结果报道如下。
文章插图
一、材料与方法
(一)菌株:新生隐球菌参考菌株d48、atcc64538、atcc64528为a血清型 , rv45981、rv59939 、rv60047、rv43185为d血清型 , rv52643、rv54135为b血清型 , rv52646、rv45978为c血清 型 , 除d48株为who赠送外 , 其余均为比利时热带病研究所赠送 。白念珠菌atcc76615由美国 辉瑞公司赠送 。罗伦特隐球菌cz18由我科真菌室保藏 。14株本科真菌室从1981年至1994年分 离或获赠新生隐球菌临床分离菌株用于本项研究 , 包括5对各分离自同一例患者的10株分离 株 。主要培养来源为脑脊液 , 个别菌株为血和脑组织 。
(二)方法:
1.真菌dna的制备:所有真菌dna制备采用高盐法[3] 。
2.pcr指纹分析:微卫星核苷酸序列5′-(gaca)4-3′用作pcr反应的单引物 。经pcr条 件的优化 , 最终采用的扩增反应体系为 , 引物0.5μmol/l , mg?2.0mmol/l , 10mmo l/l tris hcl , ph9.0 , 50mmol/l kcl , dntp每种200μmol/l , dna聚合酶2.0单位(gibco brl) , 模板1μl(约10~50ng) , 总体积50μl 。反应在pt-150 pcr扩增仪(mj research)中 进行 , 采用热启动程序 , 即在初始96℃ 5分钟变性后 , 在80℃以上加入dna聚合酶 , 加酶后 进行35个循环:92℃变性20秒 , 42℃退火40秒 , 72℃延伸1分30秒 。最后一轮反应后72℃延 伸10分钟 。取15μl扩增产物进行2.0%琼脂糖、1×tae凝胶电泳 , 观察结果、照相 。
二、结果
采用微卫星引物5′-(gaca)4-3′所有实验菌株均能得到有效扩增 , 产生长度范围为0 .5~4.0kb多达16条带的pcr指纹 。为了评价pcr指纹反应的稳定性 , 两株菌株白念珠菌atc c76615及罗伦特隐球菌cz18 , 经6次亚培养获得相同的pcr指纹(图1) 。
1:阴性对照;2~5:依次为罗伦特隐球菌cz 18初始菌株 , 罗伦特隐球菌 cz18亚培养菌株 , 白念珠菌atcc76615初始菌株 , 白念珠菌atcc76615亚培养菌株;m: 核苷酸分子量标记pgem-3zf(+)/haeⅲ和λdna-hindⅲ
图1 新生隐球菌pcr指纹分析重复性评价
11株不同血清型的新生隐球菌参考菌株在种、血清型和菌株水平上存在变异(图1、2) 。白念 珠菌、罗伦特隐球菌和新生隐球菌的pcr指纹存在明显差异 。新生隐球菌的不同血清型也表 现出一定程度的血清型间的特异性和血清型内的保守性 。另外相同血清型的不同菌株也呈现 不同程度的变异性 。
泳道1~11依次为新生隐球菌d48 , atcc6453 8 , atcc64528(sero type a) , rv45981 , rv59939 , rv60047 , rv43185(serotype d) , rv52643 , rv54135(seroty pe b) , rv52646 , rv45978(serotype d) 。泳道m1为核苷酸分子量标记pgem-3zf(+)/haeⅲ ;泳道m2为核苷酸分子量标记λdna-hindⅲ
图2 新生隐球菌参考菌株pcr指纹
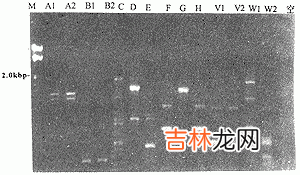
14株临床分离株进行了pcr指纹分析 。9株临床分离株具有相似的pcr指纹而与a血清型参考菌 株指纹相一致 , 提示为a血清型;3株分离株(d45 , d47 , nangjng)较前9株存在较小差异 , 而 与b、c、d血清型参考株相差显著 , 考虑为a血清型;另有2株分离株(d56、d57)其pcr指纹比 较独特 , 而与b参考菌株的指纹比较接近 , 推测它们的血清型为b 。比较5对各自分离自同一 患者的10株新生隐球菌 , 其中4对分离株具有完全一致的pcr指纹 , 而另有一对分离株(d45、 d47)在部分条带存在差异 , 重复实验获得相同的结果 , 提示它们不是同一菌株 , 而该两株菌 株是在同一患者的同一份脑脊液中分离获得的(图3) 。
经验总结扩展阅读
- 三种方法分离新生隐球菌RNA及其评价
- 药物和化学试剂体外对新生隐球菌的细胞表面疏水性和粘附性的影响
- 新生儿流泪不止是怎么一回事
- 新生儿出生当日青霉素过敏一例
- β溶血型链球菌诱发点滴型银屑病发病机制的研究
- 银屑病患者淋巴细胞对葡萄球菌和链球菌超抗原刺激的增殖反应
- 成人淋球菌性眼炎致失明一例
- 隐形眼镜每日的烦恼
- 你会戴隐形眼镜吗
- 对淋病与淋球菌L型培养文的商榷














![什么|甜菜碱的护肤功效有什么?[水信生物]](https://p3.itc.cn/images01/20210728/fc6704a6a5ad41cf834215ee61dfc025.jpeg)